醫療器械標識(Unique Device Identification,簡稱UDI),是醫療器械產品的電子身份證。
UDI已經被認為是一個改善患者結果的重要工具,同時實現更高效的召回過程,減少醫療事故,提高庫存透明度和供應鏈安全性。
國內醫療器械標識實施遵循哪些原則?
《醫療器械標識系統規則》(以下簡稱《規則》)要求,標識系統建設應當積極借鑒國際標準,遵循政府引導、企業落實、統籌推進、分步實施的原則。為更好地促進國際交流和國際貿易,優化營商環境,我國醫療器械標識系統建設借鑒了國際通行的原則和標準。建立標識系統,政府起引導作用,注冊人/備案人作為責任人負責落實,積極應用標識提升產品質量和企業管理水平。由于醫療器械的多樣性和復雜性,分步實施標識是國際通行做法。相較于美歐,我國實施醫療器械標識增加了試點環節,以部分高風險植/介入醫療器械為主,覆蓋范圍更小,確保規則穩步推進。
歐盟醫療器械標識實施遵循哪些原則?
歐盟的歐盟醫療器械法規 (MDR) 2017/745 要求醫療器械的生產商、分銷商、進口商和歐盟代表或其包裝自 2021 年 5 月 26 日起明確標記其產品。因此,醫療器械將完全可追溯至制造商向用戶提供并保證歐盟要求的患者安全。
根據醫療器械法規通過的標準和法規對所有參與者具有同等約束力。為此,醫療器械所需的產品標識由四個分配機構之一頒發 - GS1、HIBCC、ICCBBA 和 Informationsstelle für Arzneispezialit?ten。
從 2022 年 5 月起,所有醫療設備都將與它們的主數據和“唯一設備標識”(UDI)一起存儲在歐盟范圍內的 EUDAMED 數據庫中。
如何實現標識數據匯聚和共享?
醫療器械標識數據匯聚和共享通過醫療器械標識數據庫實現,該數據庫由國家藥品監督管理局組織建設,由注冊人/備案人將標識的產品標識及關聯信息按照相關標準和規范上傳至數據庫,并對數據的準確性、性負責。醫療器械經營企業、醫療機構、政府相關部門及公眾可通過數據查詢、下載、數據對接等方式共享標識數據。
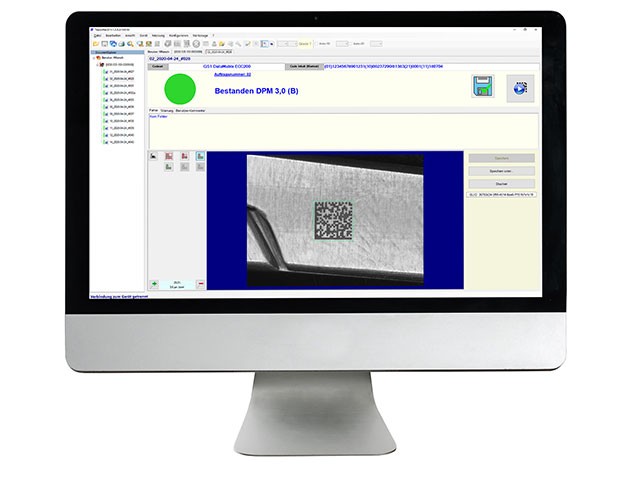
UDI碼產品標識由兩部分組成:
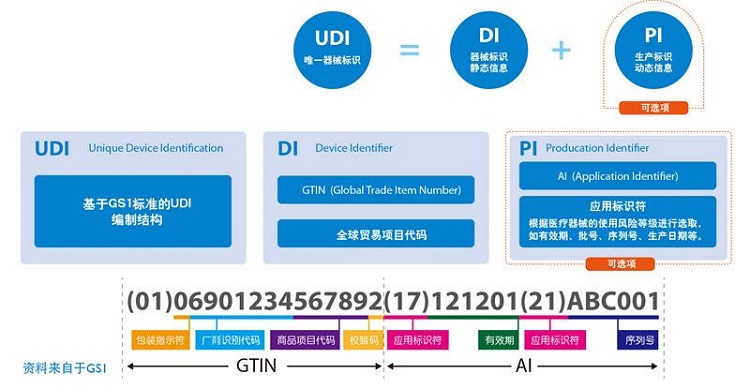
醫療器械被分類并歸入風險等級,風險等級是根據產品的使用地點和使用時間的預期目的來定義的。
有例如 一次性或可重復使用的醫療設備、植入物或其他軟件和設備等產品。
由此產生的風險等級還規定了立法中的實施期限。
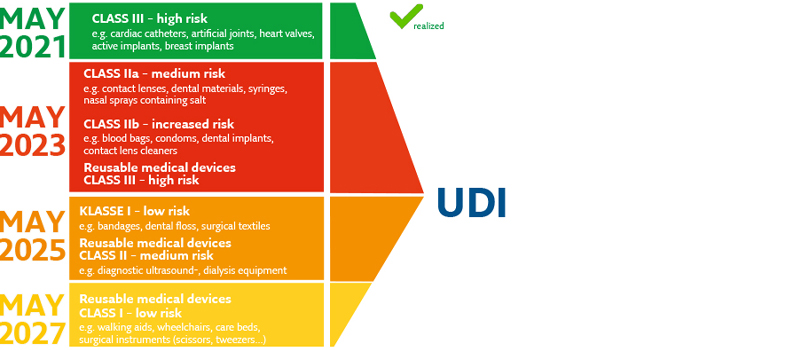
產品標識必須直接應用于產品、初級包裝或所有更高級別的包裝。 根據醫療器械法規,直接標記必須通過墨水、標簽進行。
此外,代碼必須在倉庫中和產品使用時都易于訪問和讀取 - 這貫穿產品的整個生命周期。
標記是可讀的文本和機器可讀的代碼。 可以在醫療設備上標記一維條碼或二維矩陣碼,具體取決于直接標記的可用區域。
根據醫療器械及其特性,有多種可能的標記。
藍茵高分辨率噴墨噴碼機是在產品或包裝上直接打標的理想選擇,能夠提高醫療器械制造商的工藝可靠性和效率。

使用高分辨率 (LT) 產品系列的噴碼機,可以選擇合適的UV墨水直接在產品或其包裝上、紙張、塑料、陶瓷或金屬表面(如鋁)等表面上,以高速和高打印質量進行標記,不會損壞包裝表面材質。 油墨環保零VOC,無需溶劑,耗材低。
另外,藍茵的標簽技術系統適用于無法在產品或外包裝上直接標記的地方,使用藍茵的非接觸式編碼和標記系統,非直接標記,將標簽貼在醫療產品或外包裝上。
為確保以高首次讀取率、無誤讀取代碼,并符合醫療器械法規的標準,還可使用代碼驗證系統。